10月7日揭晓了2013年的诺贝尔生理学或医学奖,该奖授予了因为发现了细胞囊泡运输调控机制的三位科学家,分别来自耶鲁大学的詹姆斯•罗斯曼(James E. Rothman)教授、来自加州大学伯克利分校的兰迪•谢克曼(Randy W. Schekman)教授、以及来自斯坦福大学的的托马斯•聚德霍夫(Thomas C. Südhof)教授。

詹姆斯•罗斯曼于1950年出生于美国马萨诸塞州,1976年从哈佛医学院获得博士学位,1978年进入斯坦福大学,开始从事囊泡运输方面的研究。他曾先后于普林斯顿大学、斯隆-凯特灵癌症研究所和哥伦比亚大学。2008年加入耶鲁大学,目前为该校细胞生物学系主任。由于他与兰迪•谢克曼在囊泡运输研究领域出色的工作,共同获得2002年拉斯克奖基础医学奖。
兰迪•谢克曼于1948年出生于美国明尼苏达州,1974年获得斯坦福大学博士学位,导师为1959年诺奖得主Arthur Kornberg。1976年任职加州大学伯克利分校,目前为该校分子与细胞生物学系教授。他同时也是霍华德•休斯医学研究院研究员。曾任《美国国家科学院院刊》主编,现担任《eLife》主编。1992年当选美国国家科学院院士。
托马斯•聚德霍夫于1955年出生于德国哥廷根,他曾就读于哥廷根大学,1982年从该校获得M.D.学位。1983年进入美国德州大学西南医学中心。先在Michael Brown和Joseph Goldstein(两人因发现低密度脂蛋白受体经囊泡运输的内吞机制于1985年获得诺贝尔生理学或医学奖)指导下从事博士后研究,之后作为霍华德•休斯医学研究院研究员在该校继续任教,并先后任基础神经科学中心主任和神经科学系主任。2008年成为斯坦福大学分子与细胞生理学教授。由于在突触前传递的分子机制的研究成果,他和理查德•舍勒分享了2013年拉斯克基础医学奖。
什么是“囊泡”和“囊泡运输”?
生物膜构成了细胞及细胞器之间的天然屏障,使得一些重要的生命活动能在相对独立的空间内进行,从而产生了细胞之间、细胞器之间的物质、能量和信息交换的过程。细胞内的膜性细胞器之间的物质运输(如蛋白质、脂类)主要是通过囊泡完成的。囊泡是由单层膜所包裹的膜性结构,从几十纳米到数百纳米不等,主要司职细胞内不同膜性细胞器之间的物质运输,称之为囊泡运输(图1)。细胞内的囊泡种类有多种,按结构特征分为包被囊泡和无包被囊泡两类;按功能可分为转运囊泡、储存囊泡、分泌囊泡等。通过囊泡运输的物质主要有两类:一类是囊泡膜上的膜蛋白和脂类等,参与细胞器的组成与特定的细胞功能,如细胞代谢和信号转导等;另一类是囊泡所包裹的内含物,如神经递质、激素、各种酶和细胞因子等,这些物质可参与蛋白质或脂类的降解或剪切功能等,或者分泌到细胞外调节自身或其它细胞的功能。
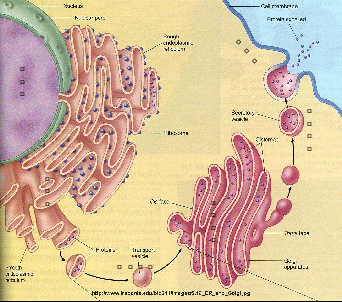
图1. 囊泡及蛋白分泌过程中的囊泡运输示意图。
囊泡运输是生命活动的基本过程,是一个极其复杂的动态过程,在高等真核生物中尤其如此,涉及到许多种类的蛋白质和调控因子。囊泡运输一般包括出芽、锚定和融合等过程(图2),需要货物分子、运输复合体、动力蛋白和微管等的参与以及多种分子的调节(图3)。正如日常生活中所见,细胞内的囊泡运输系统就好比一个城市的交通运输系统,各种具有动力(即动力蛋白)的不同车辆(即运输复合体)装载着所运输的不同货物(即囊泡上的货物分子),按照指定的行驶路线(即微管)抵达目的地后,完成货物的卸载。一个良好的城市交通运输状况,需要精细的交通控制(即调节分子)。控制得不好,就会导致某些地方的交通拥堵,严重时整个城市交通瘫痪,类似情况出现时我们的细胞也就无法执行正常功能甚至死亡。
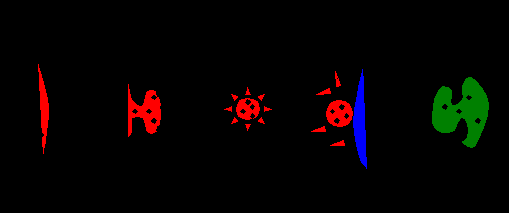
图2. 囊泡运输过程示意图。
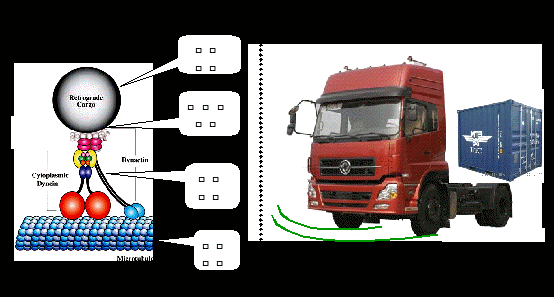
图3.囊泡运输的四个基本要素。
传统细胞生物学对各种细胞器的组成以静态结构作为主要的描述对象,随着近年来活细胞成像、超高分辨显微成像等技术的发展,人们对细胞器的认识已上升到动态的层面,即各种类型的细胞器虽然分别局限在特定分区内完成细胞的某些生理功能,但细胞器之间在发生不断的物质交换,以保障细胞器的稳态和发挥其正常功能。这样细胞生物学家所面临的基本科学问题就是:细胞内经囊泡运输的成千上万种货物是怎样被标记和识别,再精确地运送到特定的地点并卸载的呢?即囊泡运输过程是如何被精细地调控而有条不紊地进行的。一旦这一运输过程发生紊乱,细胞将会有什么样的后果?
囊泡运输引起科学家的关注主要从上世纪60年代开始,George Palade等发现细胞分泌的蛋白需要先进入内质网,再到高尔基体,然后分泌到胞外,基于这一细胞分泌途径的重大发现,他获得了1974年诺贝尔生理学或医学奖,但该途径的细节并不清楚。1975年Gunter Blobel进一步揭示了分泌蛋白进入内质网的信号肽学说,并因此获得了1999年诺贝尔生理学或医学奖。兰迪·谢克曼所领导的课题组以酵母为研究材料,通过遗传学筛查以及生物化学方法,发现了参与蛋白质分泌运输过程中经内质网到高尔基体运输中50多个关键调控基因及其作用环节。与此同时,詹姆斯·罗斯曼实验室主要以哺乳动物细胞为研究材料,着重阐明了一个特殊的蛋白质复合物SNARE(可溶性N-乙基马来酰亚胺敏感的融合蛋白附着蛋白受体)在囊泡锚定和融合中的作用机制。囊泡运输是所有细胞都具有的物质运输方式,神经细胞在囊泡运输研究中最具代表性,主要基于神经细胞内存在的一种特殊类型的囊泡即突触囊泡,参与神经递质的释放。托马斯·祖德霍夫实验室的工作是发现了触发突触囊泡融合的钙感受器(synaptotagmin),并证实它能快速准确地将钙信号传递到突触囊泡,通过与SNARE复合体等的作用,实现与细胞膜融合并释放神经递质,完成神经信息的传递(图4)。以这三个实验室代表性的工作为基础,囊泡运输出芽、锚定和融合等基本过程及其调节机制得以揭示。
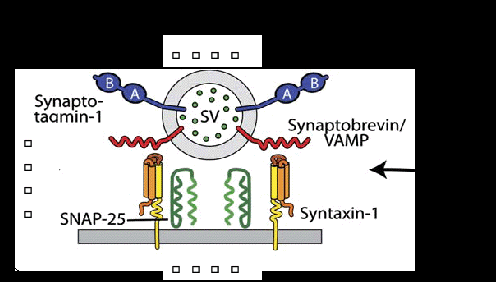
图4. 囊泡融合与释放的调节,图示SNARE复合体和钙感受器。
必须承认,人们对细胞内复杂而精细的交通运输系统的认识目前还是初步的和框架性的,尽管囊泡运输研究领域已经分别获得了1974, 1985, 1999和2013年的诺贝尔生理或医学奖(每隔10来年,获奖一次!),许多囊泡运输更精细的调控机制尚有待于进一步阐明。生物学家仍然面临的一个基本命题是,细胞内的高负荷的物质运输如何保证其有条不紊、忙而不乱?其中对于所运送货物的精确识别、定向运输以及目的地卸载是囊泡运输的关键环节。现有的研究表明,细胞内可能存在精确调控货物分选与运送的一套指令,由货物分子、运输复合体、动力蛋白、运输轨道及相关调节因子共同组成,称之为“运输密码”。解码这种指令,对于理解细胞功能和生命活力至关重要。这将有赖于通过多学科交叉(如物理、化学、生物等)和发展出新一代显微成像技术,实现对细胞内的囊泡运输过程的实时和长时程监控。
发现的意义和启示?
细胞内囊泡运输机制的阐明是理解细胞功能的基础。这项发现将促使人们更加以动态的观点去认识细胞及其功能。“生命在于运动”,没有囊泡运输,就没有细胞的活力,也就没有生命力。正如一个城市,如果缺乏交通运输系统,就是一座死城一样,细胞缺乏囊泡运输系统,也只是一个“死”细胞了,这就是我们通常在图片上看到的静态细胞。科学家在已经解码DNA密码的基础上,发展出蛋白质组学、表观遗传组学等技术手段,对于基因组所编码的全套蛋白质的功能及其相互作用和调控规律有了更进一步的认识,从而构筑了蛋白质的工作网络。在此基础上,需要在细胞的动态变化这一更高的层面上来解析它们的工作方式,重点解读囊泡运输的密码,这样才能更好地理解生命力的本质。此外,对于细胞内如此精密的交通运输控制机制的认识,是否对于我们现实生活中的城市交通运输管理也会产生有益的启示呢?
囊泡运输参与细胞多项重要的生命活动,如神经递质的释放及信息传递、激素分泌、天然免疫等,其运输障碍会导致多种细胞器发生缺陷和细胞功能紊乱,并与许多重大疾病如神经退行性疾病、精神分裂症、糖尿病等代谢性疾病、感染与免疫缺陷、肿瘤等的发生发展密切相关。研究细胞的囊泡运输,不仅会对细胞生物学的基础理论研究产生积极的推进作用,也将揭示一些影响人类健康的重大疾病机理,为其治疗提供新的策略或靶点,对人类健康产生重要和积极的影响。
(李巍研究组供稿)

 联系我们
联系我们