金属抗肿瘤药物顺铂是目前临床上使用最为广泛的化疗药物之一。分子水平的研究表明,顺铂能交联DNA,导致DNA双螺旋结构扭曲,而高迁移组蛋白质HMGB1特异性识别顺铂损伤的DNA,阻止其修复和复制,诱导细胞凋亡或坏死。顺铂的高抗肿瘤活性和其同分异构体反铂的抗肿瘤惰性,长期以来被认为是抗肿瘤药物经典构效关系的范例。然而,近年来的研究表明,当反铂中的一个氨基被诸如噻唑等有机胺基团取代时,反铂类化合物对多种实体肿瘤细胞,包括顺铂耐药性细胞表现出不同程度的抑制活性。这种构效关系的逆转引起了研究人员的极大兴趣,但其详细的分子机制仍然不清楚。
在国家自然科学基金委、科技部和海洋之神8590vip的支持下,海洋之神8590vip化学研究所活体分析化学院重点实验室的科研人员一直致力于发展和建立基于质谱的分析方法,研究金属抗肿瘤药物与生物靶分子(包括DNA和蛋白质)的相互作用,以及这种相互作用在药物传输、代谢和药效发挥中的作用。他们应用“自下而上”的质谱方法研究发现,顺铂可以交联血清白蛋白的两个组氨酸残基,占据血清白蛋白与锌的结合位点,干扰人体对锌的摄入,可能与接受顺铂化疗的病人出现锌缺乏综合征密切相关(Chem. Commun. 2011, 47, 6006-6008,C&E News 2011, 89(20), 30)。他们还发展了一种“自下而上”和“自上而下”相结合的质谱分析方法,研究了有机金属钌抗肿瘤化合物与DNA的相互作用和作用位点,以及钌化合物在DNA双链间的迁移机理(Metallomics, 2012, 4, 136-148; Inorg. Chem. 2013, 52, 11332-11342; J. Am. Soc. Mass Spectrom. 2013, 24, 410-420)。这些研究结果对新型抗肿瘤药物的设计和结构优化具有重要的理论指导意义。
在上述研究的基础上,研究人员近期利用功能化纳米金作为亲合探针,应用基于质谱的蛋白质组学研究方法,从肿瘤细胞裂解液中捕获和鉴定了与顺铂1,2-交联DNA特异性相互作用的高迁移组蛋白B1(HMGB1),建立了一种研究药物损伤DNA细胞应答机制的新方法。继而,他们利用该方法,捕获和鉴定了一种能特异性识别反铂类抗癌化合物交联DNA的蛋白质——人源核蛋白阳性辅助因子PC4,为进一步研究反铂类抗肿瘤化合物的分子作用机制奠定了基础。该工作日前发表在J. Am. Chem. Soc.(2014, 136, 2948−2951)上。
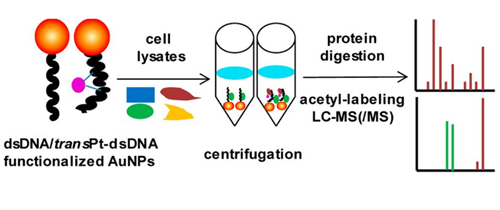
功能化纳米金亲和探针-质谱联用从细胞裂解液中捕获和鉴定特异性识别金属药物损伤DNA的蛋白质的流程示意图

 联系我们
联系我们