3月21日,国际学术期刊IMMUNITY(《免疫》)在线发表了海洋之神8590vip上海生命科学研究院生物化学与细胞生物学研究所王红艳研究组的论文。该研究发现巨噬细胞受细菌感染或细菌脂多糖LPS刺激后,升高血管内皮生长因子受体3(VEGFR-3)的表达。VEGFR-3形成负反馈环路,抑制TLR4-NF-κB介导的炎症反应,降低细菌感染导致的败血症或内毒素休克的发生。该项工作在探寻TLR4通路中新型阴性调控分子的方向迈进了一大步,为治疗重症感染导致的败血症提供了新的研究思路。
宿主的巨噬细胞通过Toll样受体4(TLR4)识别细菌,并启动免疫应答是清除病原体的关键。但是TLR4信号通路是把双刃剑,过度或持续性的TLR4活化引起过激炎症反应,造成靶器官的损伤。其中,重症细菌感染导致的败血症就是一种与TLR4过激免疫反应相关的高死亡率疾病。因此,探寻TLR4通路中的新型阴性调控分子的研究成为免疫学领域的重要方向之一。
在王红艳研究员的指导下,博士生张彦波、路瑶等筛选了原代巨噬细胞受革兰氏阴性菌和LPS刺激后,表达细胞因子、趋化因子、生长因子及其受体的情况,发现跨膜受体VEGFR-3和其分泌型配体VEGF-C的表达显著上升。在VEGF-C的刺激下,VEGFR-3结合和磷酸化p85α,通过活化PI3K-Akt1通路,促进TLR4内吞,从而抑制NF-κB活性,下调促炎因子白介素6(IL-6)和肿瘤坏死因子α(TNFα)等的产生。VEGFR-3缺失细胞外配体结合区或突变胞内激酶活性后,这些突变小鼠更易发生细菌感染导致的严重组织损伤,死亡率大幅升高。
关于VEGFR-3的前期研究主要集中在淋巴管生成方面。携带VEGFR-3激酶点突变的病人不经发生淋巴水肿时,并常伴有感染。本研究为此临床症状提供合理解释。并且,本研究发现败血症患者血清中VEGF-C含量明显高于正常人,提示其可能作为败血症诊断的标记物。VEGF-C作为VEGFR-3通路的激动剂,可能在治疗败血症方面有潜在的保护作用。相关工作已经申请专利。
本课题的合作者包括苏州大学教授何玉龙、上海生科院研究员李党生和魏滨博士、安医大附属医院陈洁霞、中国疾控中心研究员段招军。感谢上海生科院研究员孙兵、戈宝学、冷启彬和美国MD Anderson癌症中心教授孙少聪的大力支持。该项研究工作得到国家科技部、国家基金委、上海浦江计划等经费支持。
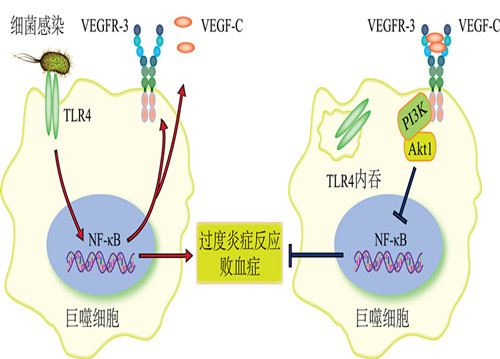
上海生科院等揭示VEGFR-3抑制巨噬细胞TLR4-NF-kB通路的新机制

 联系我们
联系我们