3月27日,《自然—通讯》(Nature Communications)杂志在线发表了海洋之神8590vip上海生命科学研究院营养科学研究所刘勇研究组的最新研究进展——Hepatic IRE1α regulates fasting-induced metabolic adaptive programs through the XBP1s-PPARα axis signalling 。该项工作揭示了肝脏内质网应激IRE1α信号通路在机体能量代谢的适应性反应中所发挥的生理学作用和调节机制。
内质网(Endoplasmic Reticulum, ER)是真核细胞中蛋白质折叠加工与质量监控、脂类合成与分泌的重要细胞器,其稳态平衡对于维持细胞功能至关重要。当内质网不能承担蛋白折叠的高负荷或内质网中脂类代谢发生异常,就会引发细胞内质网应激(ER Stress)而激活未折叠蛋白响应(Unfolded Protein Response, UPR),从而增强内质网的应对处理能力。大量研究显示,内质网应激是连接肥胖、胰岛素抵抗和2型糖尿病的重要病理机制之一。在哺乳动物细胞中,内质网跨膜蛋白IRE1α(Inositol Requiring Enzyme 1α)集蛋白激酶与RNA内切酶功能于一体,通过调节转录因子XBP1的活性介导一条关键的UPR信号通路。
刘勇研究组在前期研究中,揭示了小鼠肝脏IRE1α通路在葡萄糖异生与糖代谢紊乱中所发挥的重要作用(Mao et al, PNAS, 2011)。该研究组博士研究生邵孟乐、闪波等进一步研究发现,长期禁食或喂食产酮饲料能导致肝脏中IRE1α-XBP1信号通路的激活;在肝细胞特异性敲除Ire1α基因小鼠模型中研究发现, IRE1α缺失导致肝脏脂肪酸氧化和产生酮体能力的下降,造成肝脏脂质堆积;研究还表明,IRE1α通过激活下游转录因子XBP1控制调节饥饿反应的关键调控因子—核受体PPARα的转录表达,从而在营养缺乏情况下参与调节肝细胞线粒体中脂肪酸氧化和酮体生成的代谢途径。这项研究揭示了肝脏IRE1α在适应性饥饿反应中扮演“营养感应器”的重要角色,为深入了解内质网应激与糖脂代谢紊乱的机制关联提供了新的线索。
该项研究得到科技部重大研究计划、国家自然科学基金委、上海市科委及中科院等部门的基金支持,以及中科院上海药物研究所/国家新药筛选中心李佳研究组、上海交大第六人民医院贾伟平研究组的合作支持。
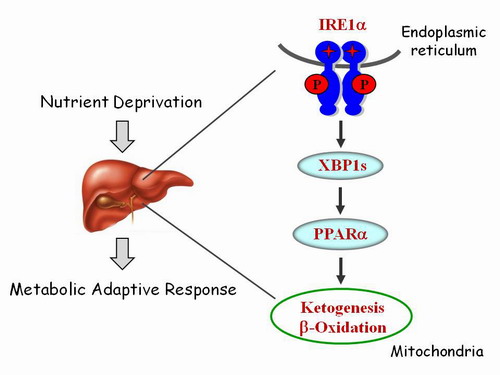
内质网应激IRE1α通路调节机体饥饿状态下肝脏代谢的适应性反应

 联系我们
联系我们