不同于原核生物,真核生物mRNA (messenger RNA)具有5’帽子结构。帽子结合蛋白复合物(CBC,cap binding complex)能特异地与5’端帽子结构结合,顺利将mRNA输出细胞核。CBC对于蛋白质合成的质量控制、mRNA的稳定性、Pre-mRNA的正确剪切、microRNA的成熟过程以及mRNA的3’-PolyA化都起到重要的调控作用。CBC蛋白可分为核内CBC (nuclear cap binding complex),比如单细胞酵母的CBC1/2蛋白与多细胞的CBP20/80蛋白,和胞质内CBC(Cytoplasmic cap-binding complex),比如转录起始因子eIF-4E与eIF-4G并启动mRNA的翻译过程。一般mRNA在核内与CBP20/80 (或CBC 1/2)结合以后,经核孔运输到胞质中,CBP20/80在胞质中被eIF4E/G取代并启动mRNA的翻译过程。越来越多的证据表明,植物CBP20/80蛋白参与调控叶片的发育,以及对脱落酸的响应过程,但是它们是否参与调控更多的非生物胁迫过程及其内在分子机制尚未有深入研究。
定量蛋白质组学(Quantitative Proteomics)是对一个生物体全部蛋白质或一个复杂混合体系内所有蛋白质进行精确鉴定和定量。可用于筛选和寻找任何因素引起的样本之间的差异表达蛋白,结合生物信息学揭示细胞生理功能,同时也可对某些关键蛋白进行定性和定量分析。iTRAQ(isobaric tags for relative and absolute quantitation)技术是近年来发展起来的一种定量蛋白质组学技术。昆明植物研究所杨永平与胡向阳研究组的博士生孔翔祥利用模式植物拟南芥 (Arabidopsis thaliana) 为材料,结合定量蛋白组学技术解析CBP20/80蛋白调控拟南芥响应盐胁迫的内在机理。我们获得了CBP20/80基因的T-DNA插入缺失突变体cbp20与cbp80,这两个突变体都表现为对盐胁迫的敏感性;利用iTRAQ技术定量比较了野生型拟南芥、cbp20与cbp80在盐胁迫下蛋白质组的变化,发现了77个差异表达明显的蛋白,基因表达分析表明在cbp20与cbp80突变体中多数蛋白表达下调是因为它们失去了CBP20/80蛋白指导Pre-mRNA正确剪切的功能,从而不能正确有效去除内含子而影响Pre-mRNA的正确转录翻译。生物信息学分析发现这些蛋白参与脯氨酸与糖代谢过程,以及蛋白泛素化与SUMO化修饰过程。进一步的生化分析表明在盐胁迫情况下,cbp20与cbp80突变体不能正确剪切P5CS1基因与IDD14基因,导致不能有效地积累脯氨酸与对淀粉的有效降解,从而导致对盐胁迫的敏感性。
该研究结果以Quantitative proteomics analysis reveals that the nuclear cap-binding complex proteins Arabidopsis CBP20 and CBP80 modulate the salt stress response 为题发表在蛋白组主流杂志Journal of Proteome Research并受到审稿人的一致好评。该研究项目得到云南省中青年学术技术带头人后备人才项目(No.2012HB041)与自然基金委项目(No. 31170256)资助。
文章链接
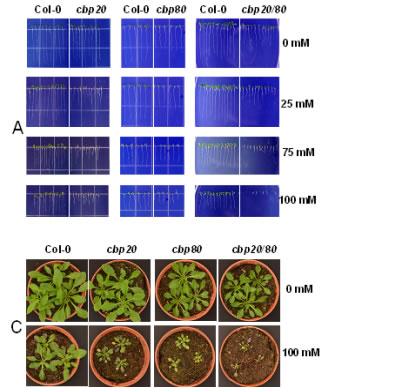
A:野生型拟南芥、cbp20与cbp80突变体在不同梯度盐平板下根伸长状况。B:野生型拟南芥、cbp20与cbp80突变体在不同梯度土壤下生长状态。

 联系我们
联系我们