近日,海洋之神8590vip北京基因组研究所基因组科学与信息重点实验室雷红星研究组,在其开展的转录因子TALE(transcription activator-like effector)和DNA相互作用研究方面取得阶段性进展,该研究对TALE蛋白的构象可塑性以及特异性识别DNA的机制进行了深入的计算分析,通过对去除DNA的TALE蛋白进行分子动力学模拟,对TALE蛋白结合DNA的机制提出了新的认识。
TALE蛋白是一个序列可编程的转录因子,由34个氨基酸的重复序列组成。每个重复序列形成两个螺旋,这两个螺旋通过一个短的环(Loop)连接。Loop内含有重复数可变的双氨基酸(Repeat-variable di-residues,RVDs),可以特异性识别DNA碱基。尽管晶体结构描述了TALE蛋白在开放状态和结合DNA状态之间的转变,但这两种构象如何在较低的能量消耗下实现转换以及RVDs识别DNA碱基的机制都不清楚。
为此,雷红星研究员及其研究团队围绕着以上两个方面对TALE-DNA相互作用进行了计算分析,以便更好地理解相互作用过程中能量的变化。在对结合DNA和自由的构象分别进行分子动力学模拟后,研究人员均发现TALE蛋白具有很高的弹性,而且两者之间有很低的自由能势垒,只需要很少的能量TALE蛋白就能结合DNA。
与此同时,为了分析TALE蛋白识别DNA的特异性,研究人员利用PBSA(Poisson–Boltzmann surface area)以及其他方法去计算RVDs和DNA碱基多种组合的自由能。PBSA计算结果表明,正确的RVDs-碱基配对与错误的配对相比具有较低的自由能。
在这些分析的基础上,该理论分析为理解TALE蛋白结合DNA的动态过程以及伴随的能量变化提供了新的视野。
论文链接
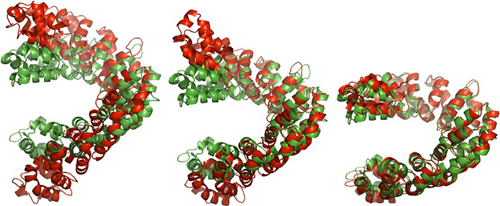
三个具有代表性的分子动力学模拟轨迹。其中红色为模拟的结构,绿色为TALE蛋白结合DNA的参照结构。

 联系我们
联系我们