9月16日,国际学术期刊Cell Research 在线发表了海洋之神8590vip上海生命科学研究院生物化学与细胞生物学研究所胡荣贵课题组的最新研究成果,文章中报道了一种基于双荧光的蛋白质组水平检测蛋白质稳定性变化的方法(Protein turnover assay, ProTA),以及利用该方法系统地研究了化疗药物蛋白酶体抑制剂硼替佐米(Bortezomib, BTZ)的药物作用及其肿瘤细胞产生耐药性的可能机理。
蛋白质水平的维持基本稳定和适度动态变化是细胞保持活力和进行生命活动的基本特征和必要前提。蛋白质稳态由蛋白质翻译、折叠、去折叠、翻译后修饰及降解等环节组成。其中,蛋白质降解作为蛋白质稳态调控中的终端步骤,对于调节蛋白质的丰度及功能发挥着极其重要的作用。研究表明,蛋白质降解的精细调控着信号传递、生存、增殖等几乎每一个基本细胞生命活动,也影响或决定细胞对包括药物反应、微生物感染等内外刺激的反应方式和后果。蛋白质降解异常,是癌症、退行性疾病、肿瘤耐药性等发生发展的基本特征和成因之一。因此研究蛋白质的降解不仅有助于深化对细胞的基本生命过程以及相关疾病发生发展机制性认识,而且有助于开发新的疾病诊治方法。然而,目前可在组学水平系统研究蛋白质降解的工具除质谱技术之外,并不多见。
文章第一作者于涛等结合流式细胞仪(FACS)和DNA芯片技术,开发了一种可以在蛋白质组水平相对定量检测蛋白质稳定性的技术,即ProTA (流程如图所示)。该技术克服了质谱技术“无法可靠地检测丰度低但是功能关键的蛋白”的瓶颈,应用ProTA技术可以在活细胞中同时监测超过15000多种蛋白质的稳定性及其变化。作为该技术的概念性验证,作者利用ProTA技术系统研究了目前市值数十亿美元的肿瘤化疗药物蛋白质酶体抑制剂BTZ的药物作用及其肿瘤细胞抗药性产生的可能机理。该项研究发现BTZ处理导致细胞内脂肪酸代谢和白介素6信号途径上调等,从而可能参与促进肿瘤耐药性形成。实验数据表明,基于这些靶点理性化设计新的药物联用方案,可能有助于克服肿瘤细胞对BTZ耐药性。同时,作者还意外地发现了细胞内重要细胞器蛋白酶体稳态调控的新机制。显然,ProTA技术作为研究蛋白质降解组的新方法,可以与质谱技术互补使用,在现有基因组、转录组等组学水平研究之外,系统研究和表征细胞受到信号刺激如药物处理和微生物感染、特定基因突变或表达改变、细胞不同发育与分化状态间的转变等情况下的关键蛋白质及分子网络的稳定性变化。目前ProTA技术的进一步的系列应用,正在进行或已部分完成,研究成果也在整理中。
课题在胡荣贵研究员的指导下完成。参与该研究的合作单位还包括中科院上海生科院生化与细胞所阮康成实验室、王红艳实验室、中科院上海生科院营养所张焱实验室、上海长征医院侯健实验室。该课题获得复旦大学附属华山医院陈字和张涛博士的大力协助。台湾中研院严雪琪研究员、中科院上海生科院生化与细胞所的吴家睿研究员、李党生研究员、王劼博士、德国歌德大学的Ivan Dikic教授、加州理工学院的Shirley Diamond教授等也提供了非常有益的建议和帮助。该项研究工作得到了中科院、国家科技部、国家自然科学基金委等经费支持。
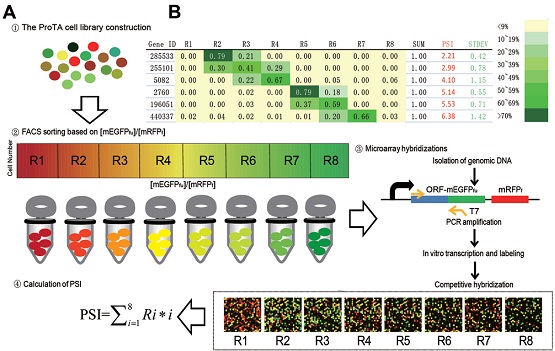
Figure 1. A schematic view of the work flow for ProTA (Protein turnover assay)

 联系我们
联系我们