长非编码RNA(long noncoding RNA,lncRNA),一般是指长度大于200个核苷酸,但是不具有编码功能蛋白质能力的长链RNA分子。已有很多研究表明,lncRNAs广泛参与一系列的基因表达调控和生物学过程。有意思的是,许多lncRNAs所介导的调控是发生在细胞核内的,因此需要新的工具来研究其在细胞核内的功能。
如同研究编码基因一样,lncRNA也需要通过质粒载体将其在细胞内进行过表达来研究。然而,目前已知的真核表达载体多数是用来表达编码基因的,载体上含有转录元件、翻译元件和一些促进核质运输(细胞核和细胞浆运输)的元件。因此,这些载体上的转录本就会按照mRNA的加工方式进行加工,并且运到细胞浆里。使用这些载体外源表达一些仅定位在细胞核中的lncRNAs时,这些RNA经常会被运到胞浆里,从而阻碍了其功能的正常发挥,导致出现错误的实验结果。
因此,针对上述现有技术中所存在的问题,同时基于实验室近期发现的一类新型的lncRNA,sno-lncRNA(不含5’帽子和3’尾巴,两端以snoRNA结尾,滞留在细胞核中,Yin et al., Mol Cell, 2012),研究人员设计并构建了一种可以把外源的RNA滞留在细胞核内的表达载体,即snoVector。该载体是由pZW1载体(Wang et al., Cell 2014)改造而来。pZW1载体中的EGFP基因被一个含有多克隆位点的内含子分成两部分,只有当内含子被剪接下来后,才能形成成熟的egfp mRNA,并产生绿色荧光蛋白。研究组在pZW1载体序列多克隆位点中插入两个snoRNA基因,并保留多个酶切位点,便于插入要表达的外源RNA(如图)。当该质粒转染细胞时,含有外源RNA序列的sno-lncRNA能够被表达,通过观察EGFP的产生可以监测sno-lncRNA的加工。
研究组以细胞核内定位的lncRNA,如NEAT1、HOTAIR为研究对象,成功地提高了它们在细胞核的定位。重要的是,研究人员还证明以这种载体表达的两端以snoRNA结尾的NEAT1可以模拟其内源RNA的功能,并发挥生物学作用。研究还证明该snoVector载体可以很有效地表达几乎任何长度在3kb以内的RNA,并使其滞留在细胞核内。例如该载体可以将原本定位于胞浆中mRNAs,如SNRPN、CEBPA等表达并滞留在细胞核内;一些通常被快速降解的内含子序列也能被稳定地表达并滞留在细胞核中;另外,该载体也可以用于表达miRNAs。此外,该载体能够产生绿色荧光蛋白,并含有抗性基因,可以用于稳定表达株的筛选。
SnoVector用于过表达外源RNA并将其滞留在细胞核中,提供了一种新型的表达载体用于研究细胞核内的lncRNAs。该载体的应用将方便人们对细胞核内RNA的功能和机制的研究,为lncRNA的研究提供新的研究手段。
本课题在陈玲玲研究员指导下,主要由博士研究生殷庆飞和胡世斌完成,工作人员徐叶芬、海洋之神8590vip—马普学会计算生物学伙伴研究所杨力研究员和美国康涅狄格大学Gordon Carmichael教授也参与了该工作。该研究得到了中科院、国家自然科学基金委、科技部和上海生科院的经费支持。
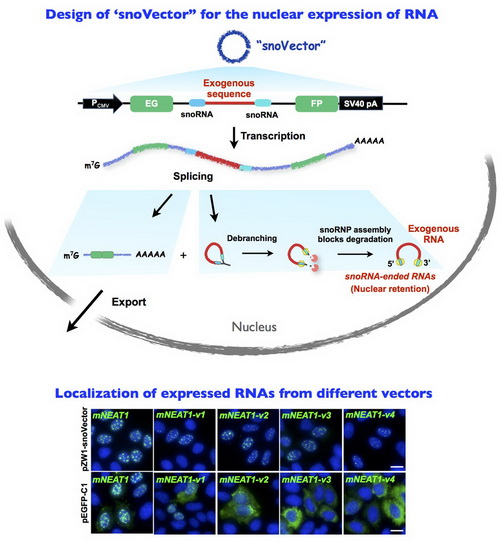
在pZW1载体序列多克隆位点中插入两个snoRNA基因,并保留多个酶切位点

 联系我们
联系我们