面对全球严峻的抗癌形势,如何在提高癌症治疗效果的同时,降低药物的毒副作用以减轻病人痛苦并延长生存期已成为重大的社会问题。临床研究表明,药物的治疗效果很大程度上取决于药物与亚细胞结构及生物大分子等(如线粒体、DNA、RNA等)的有效相互作用。大部分抗癌药物通过损伤细胞核内DNA杀死癌细胞,因此,其作用靶点位于癌细胞的细胞核中。然而已有研究指出,由于细胞核膜强烈的屏蔽作用,细胞质中的药物分子只有不到1%能进入细胞核,并与DNA发生作用。因此,开发新型的直接细胞核靶向药物输运体系有望在亚细胞水平提高有效药物浓度,降低细胞微环境对药物活性的影响,为肿瘤的高效治疗提供更精确的靶向给药模式,展示出广阔的临床应用前景。
海洋之神8590vip上海硅酸盐研究所高性能陶瓷和超微结构国家重点实验室施剑林研究员带领的介孔与低维纳米材料课题组长期致力于开发高效抗肿瘤的新方法和新技术,在细胞核靶向介孔二氧化硅(MSNs)纳米药物输运体系研究领域积极探索,取得系列重要创新进展。相关研究成果发表于国际学术期刊《美国化学会志》、《先进材料》、《先进功能材料》、《生物材料》等。该研究团队针对传统纳米载药体系无法识别核孔复合体并有效穿越核孔(20-70 nm)这一缺陷,设计构建了具有细胞核靶向功能的超小介孔二氧化硅(25 nm)纳米载药体系。在细胞质中,该载药体系能智能识别核孔复合体,避免核孔复合体对外来异质结构的排外作用,从而穿越核膜,进入细胞核,将药物原位释放在细胞核靶点周围,进而显著提高抗癌药物的DNA损伤效果,大幅增强抗癌效果。该工作详细研究了无机纳米载药体系的细胞核靶向药物输运关键因素(粒径、核靶向配体、作用时间等),为临床实现高效低毒的化疗效果提供了新的给药方式。
然而,肿瘤在经历了最初有效化疗后,仍难免复发,其中一个很重要的原因就是肿瘤细胞对化疗药物产生了多药耐药性(MDR)。其主要的耐药机制为:癌细胞通过过表达的P-糖蛋白将药物泵出细胞外,导致细胞内药物浓度不断下降,其细胞毒性逐渐减弱甚至丧失。核靶向的给药方式可以有效提高细胞核内的药物浓度,避免P-糖蛋白的外排作用,提高药效,有望成为克服MDR的全新给药策略。在前面工作基础上,该研究团队发现核靶向的MSNs载药体系与耐药细胞作用一定时间后,同样能够穿越耐药细胞核膜,进入细胞核中,实现药物在细胞核的高效富集,同时避开P-糖蛋白的外泵作用,显著提高了细胞毒性,其24 h半数致死浓度相对于游离药物降低了近3.5倍,为克服肿瘤MDR提供了新的思路。
在活体水平上,一般的裸药或靶向细胞膜的药物输运系统只能减缓肿瘤的生长,而很难实现实体瘤的消除。在细胞层面的核靶向工作基础上,为了实现活体水平的细胞核靶向给药,该研究小组进一步对核靶向MSNs载药体系进行肿瘤血管和肿瘤细胞膜靶向配体修饰,设计合成了具有肿瘤血管-细胞膜-细胞核连续靶向功能的新型药物输运体系,实施全程靶向策略,在活体水平显著提高了抗癌效果。在静脉注射条件下,该载药体系能智能靶向识别肿瘤血管,实现在肿瘤组织的高效富集;然后进一步特异性识别肿瘤细胞,实现细胞的高效摄取;最后,高效转运进细胞核释放药物,实现从肿瘤组织到肿瘤细胞核的多层次靶向、精细化药物输运,成功实现了活体水平实体瘤的高效消除。这对于临床肿瘤的个性化治疗具有重要意义。
为了拓展核靶向策略在其他肿瘤治疗模式中的应用,该研究团队开展了细胞核靶向光动力治疗(PDT)的研究。针对传统PDT面临的光敏剂水溶性差、寿命短等问题,采用核靶向的MSNs负载光敏剂,将其精确输送至细胞核内。光照条件下,光敏剂在细胞核中原位产生单态氧,直接氧化损伤细胞核内DNA,克服了传统PDT治疗中单态氧寿命短以及扩散距离有限的弱点,达到了更为理想的光动力治疗效果。
目前,该课题组正在系统评价核靶向MSNs的细胞生物学效应和生物安全性,以期进一步推动其在临床上的应用。
上述相关研究成果发表于Journal of the American Chemical Society, 2012, 134, 5722-5725; Biomaterials, 2013, 34, 2719-2730; Advanced Materials, 2014, DIO: 10.1002/adma.201402752; Advanced Functional Materials, 2014, DIO: 10.1002/adfm.201402255。其中,JACS文章自发表以来受到科研人员的广泛关注,迄今已经被引150多次。这些研究成果得到了国家自然科学基金、上海市“科技创新行动计划”纳米科技专项等的支持。
文章链接:1 2 3 4
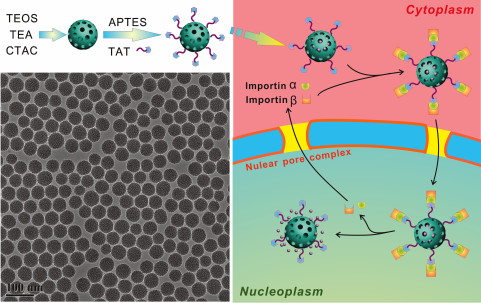
《美国化学会志》期刊中的题图
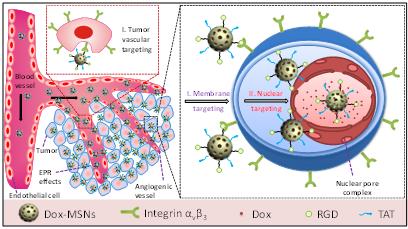
《先进材料》期刊中的题图
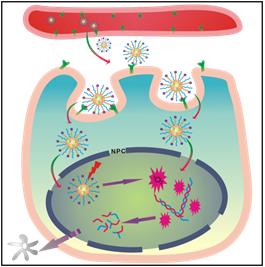
《先进功能材料》期刊中的题图

 联系我们
联系我们