屠呦呦获得诺贝尔奖后,青蒿素成为了公众关注的一个热点。记者从中科院了解到,对青蒿素这种"抗疟神药"的研究远没有大功告成,还有不少谜有待解开:青蒿素的作用机制是什么?除了疟疾,青蒿素类化合物还能治疗哪些疾病?青蒿素人工合成能否产业化?记者就此采访了中科院上海有机化学所、中科院上海药物所等单位的专家。
青蒿素为何能杀灭疟原虫
尽管青蒿素类药物拯救了数百万非洲人的生命,解除了数以亿计患者的病痛,但令人有些吃惊的是,这类药物的作用机制在科学界仍没有定论。
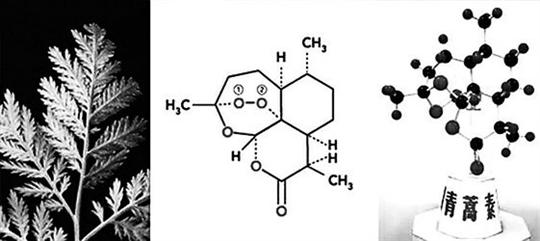
青蒿素是从植物黄花蒿叶中提取的倍半萜内酯药物,其化学结构中的“过氧桥”基团,是发挥抗疟作用的最重要结构。今年4月,《自然》杂志发表了科学家Kasturi Haldar及其同事的文章,称青蒿素以疟原虫体内的PfPI3K蛋白为目标,抑制其PI3P蛋白的生成。在临床上获得的疟原虫品种中,以及在人工培养的实验室疟原虫品种中,PfKelch13的突变都会提高PfPI3K的水平。研究团队认为,这项工作表明PfPI3K是青蒿素作用机制的关键中介物,也是根除疟疾的一个靶标。
对此,中科院上海有机化学所研究员伍贻康表示,药物分子与特定靶标蛋白的非共价结合是如今解释药物作用机制的主流理论,但用这种理论可能无法合理解释青蒿素抗疟的原因。上世纪90年代中期,美国科学院院士、化学家Posner 提出,青蒿素可能是通过自由基对疟原虫起作用的。所谓“自由基”,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成具有不成对电子的原子或基团。青蒿素进入人体后,与亚铁离子接触后发生化学反应,产生能量很大的自由基,导致细胞某些关键组分受到不可逆的损伤。
伍贻康说,这个理论也很不完善。“例如,人体内的自由基多得很,为什么其他自由基没有抗疟作用呢?科学界还没有给出令人信服的解释。”
有望成为抗肿瘤良药
虽然自由基解释还停留在假说阶段,但一些科研人员正在据此探寻青蒿素的其他功能,如治疗肿瘤、白血病。
华盛顿大学生物工程系教授赖·亨利教授团队的一项体外实验表明,青蒿素能杀灭肿瘤细胞,在与乳腺癌细胞接触16小时后,那些细胞几乎全部被杀死。亨利说,青蒿素不但有效,而且选择性很强,对癌细胞有很高的毒性,对正常细胞的影响却很小。这表明,青蒿素类化合物有望发展成无毒的抗癌良药。谈到其作用机制,他表示,“肿瘤细胞分裂时需要大量铁才能复制DNA,所以它们的铁含量比正常细胞高很多。青蒿素与亚铁离子接触后会产生自由基,因此我们想到用它来杀灭肿瘤细胞。”
实验中,研究人员将若干组乳腺癌细胞、正常乳腺细胞与全铁传递蛋白、去氢铁传递蛋白以及这两种化合物的组合接触。只接触一种化合物的细胞没有明显反应,与两种化合物同时接触的正常细胞反应也很小,而先与铁传递蛋白接触,然后与去氢铁传递蛋白接触的乳腺癌细胞反应很大——8小时后,只剩下25%肿瘤细胞;16小时后,肿瘤细胞几乎全部死亡。
体外实验还表明,青蒿素能杀灭白血病细胞。亨利认为,其原因也和自由基有关,白血病细胞的铁含量很高,其浓度可以比正常细胞高1000倍。
目前,我国多个科研团队正在研发治疗白血病的青蒿素类药物。哈尔滨医科大学杨宝峰、周晋教授等发现,白血病细胞膜是青蒿素攻击的主要靶点,其抗肿瘤机制有“凋亡”和“胀亡”两种。一旦白血病细胞膜遭到破坏,其通透性就随之改变,大量钙离子会进入细胞内,一是引起细胞程序化死亡,即凋亡;二是导致细胞内的渗透压发生变化,吸收大量水分,使细胞膨胀直至死亡,即胀亡。
红斑狼疮候选新药进入临床
“青蒿素真是大自然的馈赠!”中科院上海药物所左建平研究员说。近日,左建平研究组与李英研究员历时15年研发的治疗系统性红斑狼疮的1.1类候选新药“马来酸蒿乙醚胺”,获得国家食药监局核准的I、II、III期临床研究批件,即将启动临床试验。
系统性红斑狼疮是一种难治性自身免疫性疾病,长期缺乏新型治疗药物。流行病学调查显示,我国系统性红斑狼疮患者达数百万人。由于这种疾病的发病机制还不清楚,药物研发十分困难。1955年以来,美国食药监局(FDA)没有批准任何一个治疗系统性红斑狼疮的化学新药上市。2011年,FDA 批准了一个抗B淋巴细胞激活因子的抗体药物用于系统性红斑狼疮治疗,但高昂的治疗费用将绝大部分患者拒之门外。
自2000年以来,中科院上海药物所科研人员针对青蒿素类化合物,开展了以免疫调节活性为导向的药物化学与药理学研究,合成多系列新型青蒿素衍生物。在这些化合物中,他们发现了一批具有更强免疫抑制活性、口服吸收好的水溶性衍生物,通过成药性研究评价,最终选定了“马来酸蒿乙醚胺”。十余年研究证实,它能抑制自身免疫异常反应,恢复机体的免疫平衡。
知识产权方面,有关“马来酸蒿乙醚胺”的2项专利已获中国、美国、欧盟和日本授权,不会再出现当年青蒿素抗疟药无专利保护的遗憾。
人工合成青蒿素取得突破
与青蒿素新的治疗用途一样,可实现工业化的青蒿素人工合成技术,也是国内外许多科研人员关注的问题。伍贻康介绍,全球70%的青蒿素原料来自中国,来自我国四川、云南省人工种植的植物——黄花蒿(通常称作青蒿)。
种植黄花蒿要占用大量农田,而且黄花蒿中的青蒿素含量受自然气候状况制约,因此能否发展其他替代途径,成为科学界关注的问题。据介绍,人工合成青蒿素主要有生物发酵、化学合成两种方法的组合。前者采用基因工程发酵技术产生青蒿酸,盖茨基金会支持过这方面的研究。基于基因工程的该方法不足之处,是随后转化为二氢青蒿酸以及青蒿素,仍依靠化学反应。其中将二氢青蒿酸转化为青蒿素这步反应特别困难,通常需要光照引发产生的光敏氧化反应。工业上进行这种反应的难度很大,不容易控制,直到近两年才有所突破。另一种不需要光敏氧化反应的策略是用催化剂将双氧水转化为单线态氧,再用单线态氧将二氢青蒿酸转化为青蒿素。这种策略的难度其实也很大,美国企业多年前尝试过,但不太成功。
在化学合成青蒿素领域,我国科研人员近年来付出了许多心血。伍贻康曾以双氧水为过氧源,无机盐为催化剂,仅利用圆底瓶等简易设备,在室温条件下将二氢青蒿酸转化为青蒿素。实验表明,所得青蒿素的纯度很高,收获率也较好,与当时光敏氧化反应的最好结果持平。伍贻康团队发表了论文,但因为种种原因没有将其产业化。
我国青蒿素合成工业化最近的成果,是上海交大化学化工学院教授张万斌取得的。从2005年起,张万斌带领手性合成与催化团队,进行了艰苦的探索,终于在2012年有了重大进展——他们使用自主发现的特定催化剂,无需光照即可将二氢青蒿酸转化为青蒿素。其合成路线短、收获率高,适用于规模生产。
2012年至今,张万斌团队正在努力从事产业化工作。“我们已做到30升级的放大实验,还比较顺利。目前正准备做300升的放大试验,争取早日实现青蒿素的人工合成规模化生产,使青蒿素的低成本稳定供应变为现实。”张万斌说。
如今,在全球青蒿素大宗公立采购市场上,50%的份额已被印度仿制药集团抢占,欧洲制药集团的市场份额退守到不足30%,中国则在5%以下。与此同时,我国是青蒿素生产原料的最大供应国。如果青蒿素人工合成产业化成功,我国有望打破这一格局,向全球青蒿素产业分工的上游迈进。
